Решение задач онлайн 📝 на заказ без посредников.
Решение задач на заказ – простой и действенный способ сдачи проверочных работ в университете.
Задачи – это неотъемлемая часть всех технических и естественных дисциплин. Все разделы физики, химии, биологии, подразделы высшей математики и экономики – все это требует знания определенных формул, а также навыков и умений решения задач разных типов и сложности.
Чтобы научиться решать задачи, вам потребуется, как минимум, несколько дней. Они уйдут на то, чтобы как следует разобраться в теме, хорошо выучить все необходимые формулы, проработать разные способы решения задач каждого типа, а также дать информации как следует «устаканиться» в голове. Если у вас есть время и желание учиться в течение всего семестра, и вы можете позволить себе неспешно осваивать решение задач, вам очень повезло. Всем остальным мы предлагаем заказать решение задач на нашем сайте.
Большинство современных студентов занято всем на свете, но только не учебой.
Заказать решение задач
Решение задач за деньги – это простой, быстрый и эффективный способ сдать контрольную или лабораторную работу, зачет или экзамен. Если вы решили заказать решение задач, первое, что вам нужно – найти место, где это можно сделать. Выбрать из множества одинаковых предложений сайт, где решают задачи действительно качественно может быть непросто. Но мы можем сказать с уверенностью: если вы зашли на сайт Vsesdal.com, вы попали по адресу.
Почему именно у нас лучше всего оформить решение задач на заказ?
Низкие цены. Вы будете общаться напрямую с исполнителем, безо всякого посредничества. А значит, вам не придется ничего переплачивать. Решение задач за деньги на нашем сайте стоит в среднем в 2-3 раза меньше, чем на других ресурсах.
Вы будете общаться напрямую с исполнителем, безо всякого посредничества. А значит, вам не придется ничего переплачивать. Решение задач за деньги на нашем сайте стоит в среднем в 2-3 раза меньше, чем на других ресурсах.
Удобный сервис. Чтобы заказать решение задач, нужно всего лишь опубликовать проект на нашем сайте и выбрать исполнителя из числа откликнувшихся. Вы всегда сможете напрямую обсудить с исполнителем детали работы: стоимость, сроки выполнения, способы решение задач (если, к примеру, ваш преподаватель в университете требует от вас решения определенным способом) и т.п.
Высококлассные специалисты. Каждый исполнитель, зарегистрированный на нашем сайте, является дипломированным специалистом в своей области. Вы всегда можете посмотреть анкету исполнителя, прочитать там информацию о нем, ознакомиться с отзывами, оставленными предыдущими заказчиками. Доверьте решение контрольных работ настоящему профессионалу.
Гарантия на все работы. Если вдруг вы недовольны исполнителем, которому доверили платное решение задач, если он не справился с порученным ему заданием – мы возвращаем вам 100% оплаченной суммы.
Срочное решение задач
Решение задач за деньги может быть выполнено в кратчайшие сроки. Это вам нужно будет обговорить лично с исполнителем. Срочное решение задач имеет смысл заказывать в том случае, если в ближайшие дни у вас контрольная, экзамен или зачет, а времени на подготовку уже практически не осталось.
Обращаясь к нам с просьбой выполнить решение задач на заказ, вы избавляете себя от многих проблем, связанных с учебой.
Пока наши исполнители выполняют для вас решение задач на заказ, вы можете вести свой привычный образ жизни, проводить время в компании хороших людей, готовиться к Новому году или наслаждаться весенним солнышком.
На нашем сайте вы можете оформить заказ на совершенно любую работу, будь то курсовая или диплом, лабораторная или отчет по практике, доклад или чертеж. Можете даже заказать бизнес план: на нашем сайте всегда найдется исполнитель, готовый выполнить ваш заказ.
Кроме того, мы можем оказать вам онлайн помощь по физике, математике или любому другому предмету прямо во время экзамена.
Задача Коши онлайн
При постановке задачи Коши, указываются так называемые начальные условия, позволяющие однозначно выделить искомое частное решение из общего. Эти условия включают в себя значения функции и всех её производных до включительно (где -порядок дифференциального уравнения), заданные в одной и той же точке .
Поясним вышесказанное на конкретном примере. Пусть нам требуется найти частное решение дифференциального уравнения:
удовлетворяющее начальным условиям:
Первым делом, используя различные методы (Бернули, вариации произвольной постоянной Лагранжа), сначала находим общее решение данного дифференциального уравнения:
Теперь, для поиска частного решения, нам необходимо использовать заданные начальные условия.
Далее, поставляем начальные условия в функцию и её производную :
Решая полученную систему уравнений получаем значения произвольных постоянных и :
Подставляем полученные результаты в общее решение дифференциального уравнения, в результате получаем искомое частное решение:
|
|
Написать задачу и получить решение по математике
Математика – царица наук. Её язык одинаков во всех странах и континентах, и образование ребёнка начинается, прежде всего, с изучения языка и математики. Математика в тех или иных формах изучается во всех классах общеобразовательной школы, способствуя повышению умственных способностей и развитию математических навыков ученика. Учебный процесс непосредственно связан с решением различных математических задач, которые задаются ученикам как на уроках, так и в форме домашних заданий. Если вы столкнулись с трудностями в их решении, вам помогут специальные сетевые сервисы и мобильные приложения, позволяющие решить задачу по математическим дисциплинам. Ниже мы разберём их перечень, а также поясним, как ими пользоваться.
Учебный процесс непосредственно связан с решением различных математических задач, которые задаются ученикам как на уроках, так и в форме домашних заданий. Если вы столкнулись с трудностями в их решении, вам помогут специальные сетевые сервисы и мобильные приложения, позволяющие решить задачу по математическим дисциплинам. Ниже мы разберём их перечень, а также поясним, как ими пользоваться.
Math20 – универсальный сетевой ресурс для решения задач
Сервис math20.com – универсальный сетевой ресурс для решения математических задач. Сервис позволяет решать задачи и примеры по базовой математики, алгебре, тригонометрии, статистике, линейной алгебре, химии и других точных науках. Ресурс является одним из лучших в данном плане, и может быть рекомендован всем желающим быстро решить ту или иную задачу онлайн.
Для работы с ресурсом выполните следующее:
- Перейдите на https://www.math20.com/ru/reshenie-zadach-onlain/;
- Вставьте в строку проблем имеющееся у вас задание, и нажмите на кнопку «Solve»;
- Ниже просмотрите поданное системой решение.

Mateshka – поможет решить задачу с картинками
Сервис mateshka.ru представляет собой довольно универсальный решебник, позволяющий решать различные виды задач. Его функционал позволяет работать не только с отдельными примерами в полуавтоматическом режиме (как в случае предыдущего сервиса), но и загружать сфотографированные картинки с условием задачи, и получить через какое-то время готовый результат.
Для работы с сервисом выполните следующее:
- Перейдите на http://mateshka.ru/reshenie_zadach/;
- В изложенной форме на сайте укажите полный текст задачи. Введите её название, класс, текст задачи, сфотографируйте задачу и прикрепите её фото с помощью кнопки «Обзор»;
- Нажмите на «Загрузить»;
- Введите условие задачи в соответствующую форму, а затем нажмите на «Загрузить»
- Задача поступит на проверку администрации ресурса и через некоторое время станет доступна в поиске;
- Когда она будет решена, вы увидите её на данной странице сайта.

Math-solution — помощь в решении математики онлайн
Ресурс math-solution.ru пригодится учащимся, которые в том или ином объёме изучают математику и геометрию, и поможет в решении соответствующих задач. В основу сайта положены математические программы (калькуляторы) для решения задач онлайн. Все необходимые вычисления выполняются на сайте, представлен поэтапный вариант получения ответа.
Для работы с сервисом выполните следующее:
- Перейдите на math-solution.ru;
- Сверху выберите один из аккаунтов для авторизации на ресурсе;
- Справа снизу в разделе «Список задач» выберите тип задачи, который вам необходимо решить;
- В открывшейся форме введите условие задачи, а затем нажмите внизу на кнопку запуска решения;
- Просмотрите полученный результат.
Math.semestr.ru – онлайн-калькулятор
Сервис https://math.semestr.ru/example.php представляет собой различные калькуляторы по направлениям, включая высшую математику, аналитическую геометрию, вычислительную математику, статистику и другие дисциплины. Для решения имеющейся у вас задачи перейдите на данный ресурс, выберите интересующий вас калькулятор, тип задачи, вбейте данные, и нажмите на «Решить».
Для решения имеющейся у вас задачи перейдите на данный ресурс, выберите интересующий вас калькулятор, тип задачи, вбейте данные, и нажмите на «Решить».
Кontrolnaya-rabota.ru – решение математических задач онлайн
Еще одним ресурсом для решения математических задач является kontrolnaya-rabota.ru, позволяющее ввести автоматическое уравнение и получить его автоматическое решение. Интерфейс сервиса очень прост и интуитивно понятен, позволяя быстро получить нужный результат. Выполните следующее:
- Перейдите на https://www.kontrolnaya-rabota.ru/s/#go;
- Выберите тип необходимого для решения уравнения, имеющегося у вас в задаче;
- Кликните на кнопке запуска решения.
Англоязычной альтернативой для решения различных типов математических задач является сервис webmath.com. Данный сайт генерирует ответы на определённые математические вопросы и задачи, вводимые пользователем. Ответы генерируются и отображаются в реальном времени. Помимо ответов, сервис показывает учащимся, как пройти к тому или иному ответу.
Для работы с сервисом выполните следующее:
- Перейдите на https://www.webmath.com:443/;
- Нажмите на стрелочку справа от «Math help item» и выберите тип нужной задачи для решения;
- В открывшейся форме введите нужный тип задачи и просмотрите результат.
Альтернативным англоязычным ресурсом для поиска решения задач по математике является quickmath.com. Его функционал также позволяет в автоматическом режиме решать различные виды математических задач. Работа с ним не отличается от сервисов-аналогов. Перейдите на ресурс, введите в специальное поле задачу для решения, и нажмите внизу на «Solve».
Через несколько секунд вы получите результат с вариантами ответа.
Мобильные приложения для решения математических задач
Также отметим ряд специализированных математических приложений, позволяющих с помощью вашего телефона решить ту или иную задачу. Они следующие:
- «Photomath» (Андроид, iOS) – одно из ведущих мобильных, позволяющих ввести задачу и получить её решение по математике.
 Программа отлично пригодится для подготовки к предстоящим экзаменам по математике, она бесплатна и способна эффективно работать без Интернета. Просто запустите приложение, отсканируйте с помощью камеры телефона текст задачи, и вы получите необходимый ответ. Предоставляемое решение программа разбивает на простые шаги для лучшего понимания алгоритма ответа;
Программа отлично пригодится для подготовки к предстоящим экзаменам по математике, она бесплатна и способна эффективно работать без Интернета. Просто запустите приложение, отсканируйте с помощью камеры телефона текст задачи, и вы получите необходимый ответ. Предоставляемое решение программа разбивает на простые шаги для лучшего понимания алгоритма ответа;
- «Mathway» (Андроид, iOS) – приложение позиционирует себя как мировой лидер среди решению различных типов математических задач. Программа быстро и эффективно решает сложные математические задачи, достаточно ввести условия задачи (или снять задачу на камеру), и вы получите ответ. Приложение удобное, имеет бесплатный характер, и охватывает множество математических дисциплин;
- «Malmath» (Андроид, iOS) – приложение для эффективного решения математических задач. Он хорошо справляется с интегралами, пределами, производными, логарифмами, уравнениями и другим. Как и в случае предыдущего приложения, программа подробно объясняет необходимые шаги по решению задачи;
- «Решение математики» — мобильный инструмент, созданный специально для решения математических задач.
 Хорошо понимает различные типы математических задач, справляется с полиноминальными уравнениями различных степеней, решает тригонометрические уравнения, системы уравнений и другое.
Хорошо понимает различные типы математических задач, справляется с полиноминальными уравнениями различных степеней, решает тригонометрические уравнения, системы уравнений и другое.
Читайте также: некоторый алгоритм из цепочки символов получает новую цепочку следующим образом.
Заключение
В статье рассмотрены сетевые сервисы и мобильные приложения, позволяющие написать условие задачи по математике и довольно быстро получить её решение. Каждый из перечисленных нами инструментов может оказаться полезным в решении вашей задачи, поскольку не только предоставляет конечное решение, но подробно описывает промежуточные шаги. Столкнувшись с трудной задачей, используйте данные сервисы и приложения, которые позволят вам быстро справиться с заданием, получив высокий оценочный бал.
Графический метод решения задач линейного программирования
На этом уроке будем знакомиться с графическим методом решения задач линейного программирования, то есть, таких задач, в которых требуется найти такое решения системы линейных уравнений и (или) неравенств (системы ограничений), при котором функция цели — линейная функция — принимает оптимальное значение.
Ввиду того, что наглядность графического решения достигается лишь на плоскости, мы можем познакомиться с графическим представлением задачи только в двумерном пространстве. Это представление пригодно для системы ограничений-неравенств с двумя переменными или для систем уравнений, в которых число переменных на 2 превышает число уравнений, то есть число свободных переменных равно двум.
Поэтому графический метод имеет такие узкие рамки применения, что о нём
как об особом методе решения задач линейного программирования говорить нельзя.
Однако для выработки наглядных представлений о решениях задач линейного программирования графический метод представляет определённый интерес. Кроме того, он позволяет геометрически подтвердить справедливость теорем линейного программирования.
Итак, задача линейного программирования. Требуется найти неотрицательные значения переменных и , удовлетворяющих системе неравенств
при которых линейная форма принимает оптимальное значение.
Из теории и практики решения систем линейных неравенств известно, что множество всех решений данной системы, то есть множество пар чисел и , удовлетворяющих системе, составляет многоугольник этой системы. Допустим, что это пятиугольник ABCDE (рисунок внизу).
Линейная форма
графически означает семейство параллельных между собой прямых. При конкретном числовом значении
F линейная форма изобразится в виде некоторой прямой. Каждую из прямых этого семейства
принято называть линией уровня. На рисунке построена линия уровня
(чёрного цвета, проходит через начало координат), соответствующая значению F =0.
При конкретном числовом значении
F линейная форма изобразится в виде некоторой прямой. Каждую из прямых этого семейства
принято называть линией уровня. На рисунке построена линия уровня
(чёрного цвета, проходит через начало координат), соответствующая значению F =0.
Если исходную линию уровня передвигать вправо, то значение F при этом возрастает. Нужное направление движения исходной линии уровня можно установить следующим образом. Коэффициенты при переменных в уравнении прямой служат координатами вектора, перпендикулярного этой прямой. Таким образом, получаем градиент — вектор (на рисунке бордового цвета). Значения функции F возрастают при перемещении исходной линии уровня в направлении вектора .
Среди прямых упомянутого семейства параллельных прямых прямые mn
(зелёного цвета) и MN (красного цвета), которые назовём опорными. Опорными обычно
называют такие прямые, которые имеют с многоугольником ABCDE хотя бы одну общую точку,
и многоугольник ABCDE целиком лежит по одну сторону от этой прямой. Как видно из
чертежа, прямая mn является опорной, так как она касается многоугольника в точке
A и многоугольник целиком лежит правее (или выше) этой прямой. Прямая MN
также является опорной, так как имеет с многоугольником общую точку С и
многоугольник целиком лежит левее этой прямой.
Как видно из
чертежа, прямая mn является опорной, так как она касается многоугольника в точке
A и многоугольник целиком лежит правее (или выше) этой прямой. Прямая MN
также является опорной, так как имеет с многоугольником общую точку С и
многоугольник целиком лежит левее этой прямой.
Из основных теорем линейного программирования известно, что линейная форма достигает максимального и минимального значений в крайних точках многогранника решений. Это значит, что опорные прямые mn и MN характеризуют экстремальные значения линейной формы (функции цели), то есть в точках А и С линейная форма достигает оптимальных значений. В точке А, находящейся ближе к началу координат, функция цели достигает минимального значения, а в точке С, находящейся дальше от начала координат, — максимального значения.
1. Построить многоугольник решений системы неравенств.
Построить многоугольник решений системы неравенств.
3. Двигать прямую (или линейку) вдоль градиента — вектора параллельно линии равных значений в сторону многоугольника решений до соприкосновения с многоугольником решений. Если первая встреча с многоугольником решений произойдёт в крайней точке с координатами , то в этой точке функция цели достигает минимального значения. Если первая встреча произойдёт со стороной многоугольника, то данная функция цели достигает минимума во всех точках этой стороны.
4. Двигаясь дальше, придём к некоторому опорному положению, когда прямая будет иметь одну общую точку с многоугольником решений. В этой точке функция цели достигает своего максимума.
5. Если первоначально построенная линия равных значений пересекает
многоугольник решений, то функция цели достигает минимального значения в вершине
многоугольника, расположенной ближе к началу координат, а максимального значения — в вершине,
более удалённой от начала координат.
Пример 1. Решить графическим методом задачу линейного программирования, в которой требуется найти максимум функции при ограничениях
Построим многоугольник решений. Для этого начертим граничные прямые. Из первого неравенства запишем уравнение . Это уравнение первой граничной прямой. Найдём точки пересечения этой прямой с осями координат. При из уравнения получим , при получим . Это значит, что первая прямая отсекает от осей координат отрезки и .
Аналогично строим остальные граничные прямые. Вторая прямая от осей координат отсекает отрезки, равные 6. Третья прямая проходит параллельно оси , отсекая на оси отрезок, равный 2. Четвёртая прямая имеет уравнение . Она совпадает с осью .
Из рисунка ниже видно, что множество точек четырёхугольника ABDE
удовлетворяет всем четырём неравенствам системы.
Следовательно, четырёхугольник ABDE является многоугольником решений системы (заштрихован вовнутрь).
Начертим линию равных значений функции цели. Приняв в равенстве F =1, получим, что эта линия отсекает отрезки 1 и 1/3 соответственно на оси и на оси . Проведём прямую через эти точки (на чертеже она чёрного цвета).
Двигая эту прямую параллельно самой себе в направлении градиента — вектора (бордового цвета), получим опорные прямые. Первая прямая (зелёного цвета) имеет с многоугольником общую точку A. Здесь функция цели достигает минимума. Двигаясь дальше, придём к точке В. Здесь максимум. Координаты точки В: (2, 4). Подставляя в функцию цели координаты точки В, т. е. , , получим максимальное значение функции цели: .
На сайте есть Онлайн калькулятор решения задач линейного программирования симплекс-методом.
Пример 3. Решить графическим методом задачу линейного программирования, в которой требуется найти максимум функции при ограничениях
где .
Правильное решение и ответ.
Пример 4. Решить графическим методом задачу линейного программирования, в которой требуется найти минимум функции при ограничениях
где .
Правильное решение и ответ.
До сих пор полученные выводы были основаны на том, что множество решений задачи линейного программирования сконфигурировано так, что оптимальное решение конечно и единственно. Теперь рассмотрим примеры, когда это условие нарушается. В этих примерах многоугольник решений строится так, как показано в предыдущих примерах, остановимся же на признаках, которые отличают эти исключительные примеры.
Пример 5. Решить графическим методом задачу линейного программирования, в которой требуется найти максимум функции при ограничениях
Решение. На рисунке изображены: неограниченная многогранная область решений данной системы ограничений, исходная линия уровня (чёрного цвета), вектор (бордового цвета), указывающий направление движения исходной линии уровня для нахождения максимума целевой функции.
Легко заметить, что функция F может неограниченно возрастать при заданной системе ограничений, поэтому можно условно записать, что .
На сайте есть Онлайн калькулятор решения задач линейного программирования симплекс-методом.
Пример 6. Решить графическим методом задачу линейного программирования, в которой требуется найти максимум функции при ограничениях
Решение. Изображённая на рисунке ниже область не содержит ни одной общей точки, которая бы удовлетворяла всем неравенствам системы ограничений. То есть система ограничений противоречива и не может содержать ни одного решения, в том числе и оптимального.
На сайте есть Онлайн калькулятор решения задач линейного программирования симплекс-методом.
На сайте есть Онлайн калькулятор решения задач линейного программирования симплекс-методом.
Пример 8. Решить графическим методом задачу линейного программирования, в которой требуется найти максимум функции при ограничениях
Решение. На рисунке ниже изображены область решений системы ограничений и линия уровня (чёрного цвета). Если передвигать линию уровня параллельно исходной в направлении вектора , то она выйдет из области решений не в одной точке, как это было в предыдущих примерах, а сольётся с прямой CD, которая является граничной линией области решений.
Все точки отрезка CD дают одно и то же значение функции цели, которое и служит её оптимальным значением: . Следовательно, имеется не одно, а бесчисленное множество оптимальных решений, совпадающих с точками отрезка CD, в частности, с двумя угловыми точками C и D. Этот пример показывает, что в некоторых случаях единственность оптимального решения нарушается.
На сайте есть Онлайн калькулятор решения задач линейного программирования симплекс-методом.
Напоследок следует заметить, что строить многогранник решений можно и другим способом, отличающимся о того, который мы рассматривали. А именно: можно не искать точки пересечения прямых с осями координат, а искать точки пересечения прямых. Для этого последовательно решаются системы из двух уравнений, так, чтобы решениями были точки пересечения всех прямых. Полученные точки и будут вершинами многогранника решений. Этот способ иногда бывает удобным в случаях, когда точки пересечения прямых с осями координат — дробные числа и, неправильно отложив точку пересечения, можно получить ошибку и в поиске точек пересечения самих прямых.
Начало темы «Линейное программирование»
Поделиться с друзьями
Очень продвинутый онлайн калькулятор
Как Вы, наши уважаемые читатели и читательницы, уже могли догадаться, речь пойдет об онлайн калькуляторах, если быть точнее — об одном из самых полезных и, частенько, незаменимых изобретений человека, которое не так давно перекочевало в интернет.
Мы долго выбирали роль самого классного, удобного и полезного онлайн калькулятора и выбор пал на молодой вебдванольный сервис — Web20calc.
Вы, наверное, уже успели возмутиться относительно важности этой темы? Честно говоря, это Вы зря — калькулятор Windows ему совсем не ровня, а ближайшие соперники — типа eCalc, может и превосходят его в функционале, но стоят от 45 евро за копию и при этом устанавливаются на ПК или нетбук или Iphone, что нам не так и нужно.
Данный онлайн калькулятор может:
- Корректно выполнять стандартные математические функции, записанные одной строкой типа — 12*3-(7/2) и может обрабатывать числа больше, чемМы даже не знаем, как такое число назвать правильно (тут 34 знака и это совсем не предел). Выводится, к сожалению такое число в файл изображения (защита от автоматического использования скорее всего).
- Кроме тангенса, косинуса, синуса и других стандартных функций — калькулятор поддерживает операции по расчёту арктангенса, арккотангенса и прочих.
- Доступны в арсенале логарифмы, факториалы и другие интересные функции
Но самое главное — данный онлайн калькулятор умеет строить графики!!! Если не верите, смотрим на скриншот:
Для построения графиков, сервис использует специальную кнопку (график серый нарисован) или буквенное представление этой функции (Plot).
Чтобы построить график в онлайн калькуляторе, достаточно записать функцию, например такую как у нас в скриншоте:
plot(tan(x)),x=-360..360
Мы взяли самый простой график для тангенса, и после запятой указали диапазон переменной X от -360 до 360.
Построить можно абсолютно любую функцию, с любым количеством переменных, например такую:
plot(cos(x)/3z, x=-180..360,z=4) или ещё более сложную, какую сможете придумать.
Обращаем внимание на поведение переменной X — указан промежуток от и до с помощью двух точек.
Единственный минус (хотя трудно назвать это минусом) этого онлайн калькулятора это то, что он не умеет строить сферы и другие объёмные фигуры — только плоскость.
Для сравнения с калькулятором Майкрософта, приводим наглядный скриншот
Думаем игра «Найдите N отличий» Вам знакома. Теперь пора подвести некоторые итоги:
С помощью онлайн калькулятора мы можем:
- Серьезно облегчить себе жизнь в школе или институте.
- Получить профессиональный онлайн калькулятор в бесплатное пользование.
- Считать огромные числа на любом компьютере в любой точке планеты.
- Строить графики по сложным функциям прямо онлайн.
- Не захламлять свой ноутбук приложениями и, тем более, не тратить на них деньги.
Вполне добротный список преимуществ.
Update 21.10.2011: Мы оформили более удобную страницу с примерами для эффективного использования калькулятором — посмотреть. Её можно открыть с любой точки нашего сайта.
Update 02.12.2010: Теперь можно опробовать этот калькулятор в действии прямо у нас в журнале:
UPDATE 09.04.2011: Функции арктангенса, арксинуса и т.д. запускаются кнопками:
tan-1, sin-1 и т.д.
Включить продвинутые функции для решения матриц, построения графиков, дифференциалов и другого можно с помощью специальных клавиш:
Для полной функциональности нужно использовать оригинал, но этот тоже сойдет для быстрых рассчетов.
Технический калькулятор | Онлайн калькулятор (⇒)
Сейчас другие читают
Решаем математические задачи по фото и в браузере
Технологии развиваются, алгоритмы становятся более сложными и способными мгновенно решать задачи разного уровня сложности. Улучаются камеры в наших смартфонах. Не говоря уже про улучшения алгоритмов распознавания написанного. Решили собрать в одном материале приложения и сервисы, которые позволят решать математические формулы по фотографии с вашего телефона или прямо в браузере.
Photomath
Photomath изначально нацелен на решение задач по фотографиям. Никакого сложного ввода формул и прочего, основной элемент ввода – созданное вами фото с написанным примером. Хотя скорректировать или написать формулу вам тоже дадут. Сервис развивается, привлекает всё новые и новые инвестиции. Есть вероятность. Что именно Photomath в будущем может стать стандартом в данном классе сервисов.
Официальный сайт | Для Android | Для iOS
Mathway
Mathway похож на Photomath в плане работы мобильных приложений. Где-то лучше с распознаванием справляется первый, где-то второй. В плане интерфейса Mathway чуть более минималистичен, лично для меня это даже плюс. К тому же у Mathway есть и веб-версия, которая поможет решить задачу без необходимости устанавливать приложение на смартфон, можно набрать формулу самостоятельно или прикрепить созданную фотографию.
Официальный сайт | Для Android | Для iOS
Wolfram Alpha
Wolfram Alpha многие годы остается самым мощным инструментов в своей нише программ. Если аналоги нацелены на решение задач для учащихся или других простых уравнений, то Wolfram Alpha относится больше к классу профессиональных и научных инструментов. Возможностей очень много, есть мобильные приложения и веб-версия, но за подобные удобства и цена, которая чуть выше, чем у конкурентов.
Официальный сайт | Для Android | Для iOS
Math Scanner By Photo
Еще одно неплохое приложение для решения задач на вашем смартфоне. Доступен пока только для Android. В плане возможностей всё стандартно – распознавание и решение примера по фото или ввод его вручную. Имеется несколько подразделов. Интерфейс также прост и легок в освоении
Для Android
Fraction Calculator
Еще одно приложение доступное пока только для Android. В сети уже есть фотографии запущенного приложения на смартфоне, очень напоминающем iPhone, но пока версии для iOS нет. Приложение больше рассчитано на решение дробей. Интерфейс простой и есть возможность настраивания внешнего вида приложения.
Для Android
Camera math calculator
В данном случаи у нас приложение, которое больше старается походить на калькулятор. Что не мешает ему вводить формулы через распознавание фотографии, и даже строить графики. Интерфейс немного отличается от конкурентов. Доступен только для Android.
Для Android
MyScript Calculator
Еще одно приложение для решения задач по фотографиям. Имеет неплохой интерфейс. В некоторых моментах даже работает фишка в виде подстановки ответа с числом на пустое место прямо на фотографии. Подробные решения, по шагам, также присутствуют.
Официальный сайт | Для Android | Для iOS
Google Lens
Официальное приложение Объектива от Google. Есть отдельное приложение для Android. Для iOS всё немного сложнее, поскольку отдельного приложения нет, но сам Lens можно использовать, установив приложение Google. Стоит учесть, что решение примеров распространяется между пользователями постепенно и у некоторых пользователей оно может пока не работать и активироваться чуть позднее. К тому же, первые новшества, чаще всего, появляются сначала на Android, а уже потом, через некоторое время, становятся доступны и на iOS.
Официальный сайт | Для Android | Для iOS
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Решения для дистанционного обучения
Подробнее об ответных мерах ЮНЕСКО в области образования на COVID-19
Список образовательных приложений, платформ и ресурсов ниже призван помочь родителям, учителям, школам и школьным администраторам облегчить обучение учащихся и обеспечить социальную помощь и взаимодействие в периоды закрытия школ. Большинство предлагаемых решений бесплатны, а многие из них работают на нескольких языках. Хотя эти решения не получили прямой поддержки со стороны ЮНЕСКО, они, как правило, имеют широкий охват, прочную базу пользователей и доказательства воздействия.Они классифицируются на основе потребностей дистанционного обучения, но большинство из них предлагают функции по нескольким категориям.
Ресурсы для оказания психологической поддержки
Цифровые системы управления обучением
- CenturyTech — Индивидуальные учебные программы с микро-уроками для восполнения пробелов в знаниях, повышения квалификации учащихся и содействия сохранению долговременной памяти.
- ClassDojo — объединяет учителей с учениками и родителями для создания классных сообществ.
- Edmodo — Инструменты и ресурсы для управления классами и удаленного взаимодействия с учащимися, предлагая различные языки.
- Edraak — онлайн-обучение арабскому языку с ресурсами для школьников и учителей.
- EkStep — открытая обучающая платформа с набором учебных ресурсов для поддержки грамотности и счета.
- Google Classroom — Помогает классам подключаться удаленно, общаться и оставаться организованными.
- Moodle — открытая обучающая платформа, управляемая сообществом и поддерживаемая во всем мире.
- Nafham — онлайн-платформа для изучения арабского языка, на которой размещены образовательные видеоуроки, соответствующие учебным программам Египта и Сирии.
- Paper Airplanes — Подходит для индивидуальных занятий с личными наставниками на 12–16-недельные занятия, проводимые с помощью платформ для видеоконференцсвязи, доступных на английском и турецком языках.
- Schoology — Инструменты для поддержки обучения, обучения, выставления оценок, сотрудничества и оценивания.
- Seesaw — Позволяет создавать совместные и совместно используемые цифровые портфолио обучения и учебные ресурсы.
- Skooler — Инструменты для превращения программного обеспечения Microsoft Office в образовательную платформу.
Системы, созданные для использования на базовых мобильных телефонах
- Cell-Ed — Платформа обучения на основе навыков, ориентированная на учащихся, с возможностью работы в автономном режиме.
- Eneza Education — Пересмотр и учебные материалы для основных функциональных телефонов.
- Funzi — Служба мобильного обучения, поддерживающая обучение и тренинг для больших групп.
- KaiOS — Программное обеспечение, которое предоставляет возможности смартфона недорогим мобильным телефонам и помогает открывать порталы для возможностей обучения.
- Ubongo — использует развлечения, средства массовой информации и возможность подключения мобильных устройств для предоставления локализованного обучения африканским семьям по низкой цене и в больших масштабах, доступно на суахили и английском языках.
- Ustad Mobile — доступ и обмен образовательным контентом в автономном режиме.
Системы с сильной автономной функциональностью
- Kolibri — обучающее приложение для поддержки всеобщего образования, доступное более чем на 20 языках.
- Rumie — Образовательные инструменты и контент, позволяющие обучаться на протяжении всей жизни для малообеспеченных сообществ.
- Ustad Mobile — доступ и обмен образовательным контентом в автономном режиме.
Платформы массового открытого онлайн-курса (MOOC)
- Элисон — Онлайн-курсы от экспертов, доступные на английском, французском, испанском, итальянском и португальском языках
- Canvas Network — Каталог курсов, доступный бесплатно для учителей в целях поддержки непрерывного обучения и профессионального развития.
- Coursera — онлайн-курсы, проводимые преподавателями из известных университетов и компаний.
- European Schoolnet Academy — Бесплатные онлайн-курсы повышения квалификации для учителей английского, французского, итальянского и других европейских языков.
- EdX — Онлайн-курсы от ведущих учебных заведений.
- iCourse — курсы китайского и английского языков для студентов вузов.
- Future Learn — онлайн-курсы, которые помогают учащимся учиться, развивать профессиональные навыки и общаться с экспертами.
- Icourses — курсы китайского языка для студентов вузов.
- TED-Ed Earth School — онлайн-уроки о природе доступны постоянно в течение 5-недельного периода между Днем Земли (22 апреля) и Всемирным днем окружающей среды (5 июня).
- Udemy — курсы английского, испанского и португальского языков по навыкам ИКТ и программированию.
- XuetangX — Онлайн-курсы, предоставляемые рядом университетов по различным предметам на китайском и английском языках.
Содержание для самостоятельного обучения
- ABRA — Подборка из 33 игровых заданий на английском и французском языках для улучшения понимания прочитанного и навыков письма у первых читателей.
- British Council — ресурсы для изучения английского языка, включая игры, упражнения по чтению, письму и аудированию.
- Byju’s — обучающее приложение с большими хранилищами образовательного контента, адаптированного для разных классов и уровней обучения.
- Code It — Помогает детям изучить базовые концепции программирования с помощью онлайн-курсов, веб-семинаров в режиме реального времени и других материалов для детей. Доступно на английском и немецком языках.
- Code.org — Широкий спектр ресурсов по кодированию с разбивкой по предметам для учащихся K12, предлагаемых бесплатно некоммерческой организацией.
- Code Week — Список онлайн-ресурсов для обучения и изучения компьютерного кодирования, доступных на всех языках ЕС.
- Discovery Education — Бесплатные образовательные ресурсы и уроки о вирусах и эпидемиях для разных классов.
- Duolingo — Приложение для поддержки изучения языков. Поддерживает множество базовых и целевых языков.
- Edraak — Разнообразные ресурсы для школьного образования на арабском языке, предназначенные для учащихся, родителей и учителей.
- Facebook Get Digital — планы уроков, разговоры, мероприятия, видео и другие ресурсы, чтобы учащиеся могли оставаться на связи
- Feed the Monster — приложение для Android на нескольких языках, помогающее научить детей основам чтения, доступно на 48 языках.
- History of Africa — серия документальных фильмов BBC по истории Африки, состоящая из девяти частей, основанная на сборнике книг ЮНЕСКО «Всеобщая история Африки».
- Geekie — веб-платформа на португальском языке, которая предоставляет персонализированный образовательный контент с использованием технологии адаптивного обучения.
- Khan Academy — Бесплатные онлайн-уроки и практика по математике, естественным и гуманитарным наукам, а также бесплатные инструменты для родителей и учителей для отслеживания успеваемости учеников. Доступно на 40+ языках и соответствует национальным учебным программам более чем 10 стран.
- KitKit School — учебный пакет на базе планшета с комплексной учебной программой, охватывающей от раннего детства до младшего начального уровня.
- LabXchange — Кураторский и созданный пользователями цифровой обучающий контент, предоставляемый на онлайн-платформе, которая обеспечивает образовательный и исследовательский опыт.
- Медресе — ресурсы и онлайн-уроки по предметам STEM на арабском языке
- Mindspark — Адаптивная система онлайн-обучения, которая помогает студентам практиковать и изучать математику.
- Mosoteach — приложение на китайском языке для размещения облачных классов.
- Music Crab — Мобильное приложение, доступное для музыкального образования.
- OneCourse — ориентированное на детей приложение для обучения чтению, письму и счету.
- Profuturo — Ресурсы по различным предметам для студентов на английском, испанском, французском и португальском языках.
- Polyup — Учебные материалы для развития математики и навыков вычислительного мышления для учащихся начальной и младшей средней школы.
- Quizlet — обучающие карточки и игры для поддержки изучения нескольких предметов, доступны на 15 языках.
- SDG Academy Library — библиотека с возможностью поиска, содержащая более 1200 образовательных видео по устойчивому развитию и смежным темам.
- Сиявула — Обучение математике и физическим наукам в соответствии с учебной программой Южной Африки.
- Smart History — сайт истории искусства с ресурсами, созданными историками и научными сотрудниками.
- YouTube — Огромное хранилище обучающих видео и обучающих каналов.
Мобильные приложения для чтения
- Африканский сборник рассказов — Открытый доступ к сборникам рассказов с картинками на 189 африканских языках.
- Biblioteca Digital del Instituto Latinoamericano de la Comunicación Educativa — предлагает бесплатный доступ к произведениям на испанском языке и коллекциям книг для студентов и преподавателей в школах и университетах
- Глобальная цифровая библиотека — цифровые сборники рассказов и другие материалы для чтения, легко доступные с мобильных телефонов или компьютеров. Доступно на 43 языках.
- Интерактивная программа обучения — мобильное приложение на арабском языке для развития навыков чтения, письма и счета, созданное Агентством Организации Объединенных Наций для помощи и организации работ.
- чтения — Цифровые рассказы с иллюстрациями на нескольких языках.
- Комната для чтения — ресурсы для развития навыков грамотности у детей и молодежи со специализированным контентом для поддержки девочек.
- StoryWeaver — Цифровое хранилище многоязычных рассказов для детей.
- Worldreader — цифровые книги и рассказы, доступные с мобильных устройств и функциональные возможности для поддержки обучения чтению. Доступно на 52 языках.
Платформы для совместной работы, поддерживающие видеосвязь в реальном времени
- Dingtalk — Коммуникационная платформа, поддерживающая видеоконференцсвязь, управление задачами и календарем, отслеживание посещаемости и обмен мгновенными сообщениями.
- Lark — набор взаимосвязанных инструментов для совместной работы, включая чат, календарь, создание и облачное хранилище, на японском, корейском, итальянском и английском языках.
- Hangouts Meet — видеовстречи, интегрированные с другими инструментами G-Suite от Google.
- Teams — функции чата, встреч, звонков и совместной работы, интегрированные с программным обеспечением Microsoft Office.
- Skype — видео- и аудиозвонки с функциями разговора, чата и совместной работы.
- WeChat Work — инструмент для обмена сообщениями, контентом и видео / аудиоконференцсвязи с возможностью включения макс.300 участников, доступны на английском и китайском языках.
- WhatsApp — мобильное приложение для видео- и аудиозвонков, обмена сообщениями и контентом.
- Zoom — Облачная платформа для видео- и аудиоконференций, совместной работы, чата и вебинаров.
Инструменты для учителей для создания цифрового обучающего контента
- Thinglink — Инструменты для создания интерактивных изображений, видео и других мультимедийных ресурсов.
- Buncee — Поддерживает создание и совместное использование визуальных представлений учебного контента, включая мультимедийные уроки, отчеты, информационные бюллетени и презентации.
- EdPuzzle — Программа для создания видеоуроков.
- EduCaixa — Курсы испанского языка, чтобы помочь учителям развивать навыки и компетенции учащихся в таких областях, как коммуникация, предпринимательство, STEM и большие данные.
- Kaltura — Инструменты для управления и создания видео с возможностью интеграции для различных систем управления обучением.
- Nearpod — Программное обеспечение для создания уроков с информативной и интерактивной оценкой.
- Pear Deck — Облегчает разработку увлекательного учебного контента с различными функциями интеграции.
- Squigl — Платформа для создания контента, которая преобразует речь или текст в анимированные видео.
- Trello — визуальный инструмент для совместной работы, используемый учителями и профессорами для упрощения планирования курсовой работы, совместной работы преподавателей и организации занятий.
Внешние репозитории решений дистанционного обучения
- Brookings — Каталог из почти 3000 инноваций в области обучения. Не все из них являются решениями для дистанционного обучения, но многие из них предлагают цифровой образовательный контент.
- Common Sense Education — Советы и инструменты для поддержки закрытия школ и перехода к онлайн-обучению и домашнему обучению.
- Commonweatlh of Learning — Список ресурсов для политиков, администраторов школ и колледжей, учителей, родителей и учащихся, которые помогут в обучении учащихся во время закрытия учебных заведений.
- Education Nation — Северные страны бесплатно открыли свои образовательные решения для всего мира, поддерживая учителей и учащихся во время закрытия школ.
- EdSurge — управляемый сообществом список продуктов edtech, включая множество ресурсов для дистанционного обучения для студентов, учителей и школ, охватывающих уровни начального и послесреднего образования.
- Ресурсы Европейской комиссии — коллекция онлайн-платформ для учителей и преподавателей, доступных на 23 языках ЕС.
- GDL Radio: собрание ресурсов радио и аудио инструкций.
- Global Business Coalition for Education — Список платформ электронного обучения, платформ для обмена информацией и коммуникационных платформ.
- Keep Learning Going — Обширная коллекция бесплатных инструментов, стратегий, советов и передовых методов обучения онлайн от коалиции образовательных организаций США. Включает описания более 600+ решений для цифрового обучения.
- Koulu.me — Коллекция приложений и педагогических решений, созданных финскими компаниями в сфере образовательных технологий, чтобы облегчить дистанцию между учащимися дошкольных учреждений и учащихся старших классов средней школы.
- Международная организация франкоязычных стран: ресурсы для учащихся начальных и средних школ и учителей по изучению и преподаванию французского языка.
- Ресурсы Profuturo: ресурсы испанского языка по различным предметам для учащихся начальной и средней школы.
- Ресурсы ЮНЕВОК — инструменты, руководства, MOOCS и другие ресурсы, собранные Международным центром технического и профессионального образования и обучения ЮНЕСКО для продолжения обучения в области ТПОП.
- УВКБ ООН — обширный список из более чем 600 решений для дистанционного обучения от агентства ООН для беженцев.
Дифференциальные уравнения — Серия решений
К сожалению, для нас здесь нет ничего из первого примера, которое можно было бы использовать повторно.n}} & = 0 \ end {выровнять *} \]
Установка коэффициентов равными нулю дает,
\ [\ begin {align *} & n = 0 & 2 {a_2} + 2 {a_0} & = 0 \\ & n = 1,2,3, \ ldots & \ left ({n + 2} \ right) \ left ({n + 1} \ right) {a_ {n + 2}} — {a_ {n — 1}} + 2 {a_n} & = 0 \ end {align *} \]Теперь нам нужно решить обе эти проблемы. В первом случае есть два варианта: мы можем решить для \ (a_ {2} \) или мы можем решить для \ (a_ {0} \).По привычке решаю \ (a_ {0} \). В рекуррентном соотношении мы найдем член с наибольшим нижним индексом, как в предыдущих примерах.
\ [\ begin {align *} & n = 0 & {a_2} & = — {a_0} \\ & n = 1,2,3, \ ldots & {a_ {n + 2}} & = \ frac {{ {a_ {n — 1}} — 2 {a_n}}} {{\ left ({n + 2} \ right) \ left ({n + 1} \ right)}} \ end {align *} \]Обратите внимание, что в этом примере у нас не будет выпадения каждого третьего срока, как в предыдущем примере.
На этом этапе мы также признаем, что инструкции по решению этой проблемы также отличаются. На этот раз мы не собираемся получать общую формулу для \ (a_ {n} \), поэтому нам придется довольствоваться получением только первых двух членов для каждой части решения. Это часто имеет место в случае серийных решений. Получение общих формул для \ (a_ {n} \) является скорее исключением, чем правилом в такого рода проблемах.
Чтобы получить первые четыре условия, мы просто начнем добавлять термины, пока не получим необходимое количество терминов.Обратите внимание, что мы уже будем начинать с \ (a_ {0} \) и \ (a_ {1} \) из первых двух членов решения, поэтому все, что нам понадобится, это еще три члена с \ (a_ { 0} \) в них и еще три члена с \ (a_ {1} \) в них.
\ [n = 0 \ hspace {0,25 дюйма} {a_2} = — {a_0} \]У нас есть два \ (a_ {0} \) и один \ (a_ {1} \).
\ [n = 1 \ hspace {0,25 дюйма} {a_3} = \ frac {{{a_0} — 2 {a_1}}} {{\ left (3 \ right) \ left (2 \ right)}} = \ frac {{{a_0}}} {6} — \ frac {{{a_1}}} {3} \]У нас есть три \ (a_ {0} \) и два \ (a_ {1} \).
\ [n = 2 \ hspace {0,25 дюйма} {a_4} = \ frac {{{a_1} — 2 {a_2}}} {{\ left (4 \ right) \ left (3 \ right)}} = \ frac {{{a_1} — 2 \ left ({- {a_0}} \ right)}} {{\ left (4 \ right) \ left (3 \ right)}} = \ frac {{{a_0}}} { 6} + \ frac {{{a_1}}} {{12}} \]У нас четыре \ (a_ {0} \) и три \ (a_ {1} \). 3} + \\ & \ hspace { 0.5} + \ cdots} \ right \} \ end {align *} \]
Это решение этой проблемы, насколько нам известно. Обратите внимание, что это решение не похоже на решение в предыдущем примере. Это то же дифференциальное уравнение, но изменение \ (x_ {0} \) полностью изменило решение.
10 основных проблем электронной коммерции и их решения [2022]
Индустрия интернет-магазинов растет невероятными темпами, как и проблемы электронной коммерции.
Прислушивайтесь к проблемам электронной коммерции во время работы:
Например, рост цифровизации изменил методы работы интернет-магазинов. Хотя такой онлайн-подход упростил покупки для потребителей, он также создал уникальные проблемы для компаний, занимающихся электронной коммерцией, например, оптимизацию веб-сайтов и обслуживание через несколько цифровых точек соприкосновения.
Чтобы помочь вам, мы создали список типичных проблем электронной торговли и решений, которые вы можете попробовать:
- Необходимость онлайн-проверки личности
- Обеспечение многоканального взаимодействия с клиентами
- Превосходя огромную конкуренцию
- Необходимость пересмотра тактики продаж
- Брошенная корзина для покупок
- Поддержание лояльности клиентов
- Проблемы с возвратом и возвратом товара
- Борьба за цену и доставку
- Конкуренция с розничными торговцами и производителями
- Повышенный спрос на безопасность данных
1.Необходимость проверки личности в Интернете
Когда посетитель заходит на веб-сайт электронной коммерции и регистрируется, вам нужно каким-то образом быть уверенным, что это законное лицо, желающее совершить покупку. Таким образом вы избежите мошенничества с учетными записями или ботов, которые могут привести к потере доходов (особенно при покупках наложенным платежом (COD)).
Решение: Примите соответствующие меры для проверки информации о покупателях в Интернете. Всегда отправляйте ссылку для подтверждения при регистрации клиента. При покупках наложенным платежом автоматический звонок может даже поступать к покупателю с просьбой подтвердить адрес доставки.Кроме того, используйте автоматизацию для выявления поддельных номеров телефонов и адресов электронной почты и проверки соответствия почтовых индексов штату / городу.
И, конечно же, обратите внимание на признаки подозрительной активности. Это может быть как особо крупная сумма, так и крупный заказ.
2. Обеспечение омниканального взаимодействия с клиентами
Одна из самых больших проблем, с которыми сталкивается интернет-магазин, — это обеспечение эффективного омниканального взаимодействия с клиентами. Клиенты ожидают, что они смогут связаться с вашим брендом через любое количество точек соприкосновения, таких как ваш веб-сайт, телефон, электронная почта, социальные сети, ваш магазин и т. Д.Все эти точки соприкосновения необходимо объединить.
Создание многоканального взаимодействия с клиентами в розничной торговле позволяет компаниям общаться с покупателями по всем каналам.Фактически, согласно ecomdash, любой бизнес, который не движется к стратегии многоканальной розничной торговли, скорее всего, останется позади.
Решение: Чтобы создать действенную омниканальную стратегию, подумайте о потенциальных потребностях клиентов и внедрите правильную технологию взаимодействия с клиентами. Вот несколько шагов, которые необходимо предпринять для решения подобных проблем электронной коммерции.
- Сначала определите ключевые каналы . Как ваши клиенты обращаются к вам? Какие каналы они предпочитают?
- Интегрируйте эти каналы . Используйте технологию взаимодействия с клиентами, чтобы общаться с клиентами по их предпочтительным каналам (например, по телефону, электронной почте, в чате, видеозвонках, в онлайн-справочных центрах или в сообщениях в приложении).
- Поддерживать контекст . Используйте историю взаимодействий для информирования разговоров. Эту возможность могут предложить функции единого представления на платформах CX.
3. Превосходя огромную конкуренцию
Электронная торговля — одна из наиболее конкурентоспособных отраслей. Вариации различных параметров — затрат, услуг, операций цепочки поставок и т. Д. — могут иметь огромное значение для клиентов. Получение и поддержание вашей клиентской базы — одна из самых сложных задач электронной коммерции.
Например, если один из ваших конкурентов заключает партнерство с приложением для доставки, это может помочь им получить большую долю рынка. И это даже в том случае, если ваши цены или товары лучше.
Решение: Проведите тщательное исследование конкурентов и рынка, чтобы разработать свою стратегию цифрового маркетинга. Инвестируйте в рекламные предложения, чтобы улучшить присутствие бренда. Помните, что онлайн-компании с программами лояльности клиентов в среднем на 88 процентов более прибыльны, чем те, которые не предлагают эти программы.
Интернет-магазины с программами лояльности на 88% прибыльнее, чем без них.Кроме того, инвестируйте в лучшее обслуживание клиентов. Розничный продавец мебели Dufresne добился положительных результатов, сделав шаг к оцифровке поддержки и продаж.
4. Необходимость пересмотра тактики продаж
Одна из самых насущных проблем обслуживания клиентов в электронной коммерции — соответствовать ожиданиям современных клиентов. Многим компаниям не хватает необходимого понимания поведения клиентов и моделей покупок.
Решение: Подумайте о том, чтобы предлагать свои продукты на известных торговых площадках, таких как Amazon и eBay. У этих сайтов электронной коммерции уже есть обширная сеть покупателей, поэтому продвижение и брендинг вашего продукта (и выяснение того, что работает, а что нет) становится несколько проще.
Также сегментируйте свои данные. Сегментация посетителей позволяет компаниям электронной коммерции идентифицировать посетителей и общаться с ними на основе их пути к покупке, прошлых разговоров, географического положения, поведения при просмотре, реферальной страницы и многого другого.
Хотите предоставлять цифровые услуги, которые находят отклик у ваших клиентов? Слушайте этот подкаст о том, как улучшить свой сервис и развивать свой бренд на Shopify и за его пределами .
Брошенные корзины покупателя — огромная проблема для бизнеса электронной коммерции. Даже гиганты электронной коммерции не застрахованы от этого.
Например, когда компания Nordstrom запустила портал электронной коммерции, они стали свидетелями больших потерь от продаж электронной коммерции из-за брошенных тележек. Утомительный и заполненный ошибками процесс оформления заказа заставлял клиентов уходить в середине покупки. Эту проблему электронной торговли нельзя игнорировать.
Убедитесь, что ваша корзина электронной коммерции оптимизирована и проста в использовании, включив двухэтапный процесс оформления заказа.Решение: Nordstrom пришлось разработать новый дизайн кассы, превратив ее в гораздо более простой двухэтапный процесс.
Подумайте также о переделке корзины для покупок. Удалите ошибки или излишне длинные формы. Предложите инструменты мгновенной помощи, которые клиенты могут использовать, если они застряли. Визуальные инструменты также могут помочь ответить на запросы клиентов в процессе оформления заказа. Например, если у клиента возникают проблемы с созданием учетной записи, ваши агенты могут инициировать сеанс совместного просмотра, чтобы показать им, как это сделать.
Применение этого простого решения может значительно повысить коэффициент конверсии вашей корзины покупок.
6. Поддержание лояльности клиентов
Без доверия и лояльности клиентов вашему бизнесу придется нелегко. Но привлечение и поддержание клиентов требует огромных усилий.
Одна из причин, по которой предприятия электронной коммерции сталкиваются с трудностями при построении доверия и лояльности клиентов, заключается в том, что часто продавец и покупатель не знают или не видят друг друга. Это делает общение менее привлекательным.
Эту проблему электронной коммерции можно решить только путем времени и усилий. В конечном итоге благодаря множеству транзакций компания может укрепить это доверие и лояльность.
Решение: Сначала убедитесь, что ваши процессы обслуживания клиентов эффективны, от заказа через Интернет до доставки. Также обратите внимание:
- Отображение вашего адреса, номера телефона, фотографий сотрудников, отзывов клиентов и значков доверия на вашем веб-сайте.
- Создание ценного контента.
- Сделать обслуживание клиентов приоритетом над прибылью.
- Спрашиваем отзывы клиентов.
- Доработка программ лояльности.
Связано: Ваш информационный центр электронной торговли: Получите бесплатные образовательные ресурсы Shopify , которые помогут вам развивать свой бренд и налаживать прочные отношения с клиентами.
7. Головные боли при возврате и возврате товара
Одна из проблем, с которыми сталкиваются покупатели при совершении покупок в Интернете, — это возврат товаров.Опрос, проведенный comScore и UPS, показал, что 63 процента американских потребителей проверяют политику возврата перед покупкой, а 48 процентов будут делать больше покупок у розничных продавцов, предлагающих беспроблемный возврат.
Но, когда товар возвращается, бизнес терпит тяжелые потери в доставке и репутации. Стоимость доставки в этом случае всегда была проблемой для продавцов.
Распространенной проблемой электронной коммерции является возврат и возмещение, что упрощает процесс для обеих сторон.Решение: Вы не можете избежать хорошей политики возврата и возврата.Но вы, , можете, , тщательно выстраивать свои политики и четко сообщать о них. Примите во внимание следующие советы:
- Будьте прозрачными . Никогда не скрывайте свою политику в надежде, что клиенты ее не увидят.
- Используйте обычный английский . Важно, чтобы эти правила были понятны всем, независимо от культурного происхождения или уровня образования.
- Установите ожидания . Предоставляем разные варианты оплаты и доставки.
- Обучение персонала .Им необходимо знать вашу политику возврата, чтобы эффективно помогать клиентам.
- Будьте готовы встретить музыку . Если товар доставлен неправильно, приложите дополнительные усилия, чтобы клиент остался доволен.
8. Борьба между ценами и доставкой
Несмотря на то, что качество обслуживания клиентов является самым важным для потребителей, онлайн-продавцы часто конкурируют и по цене. Ценовая конкуренция особенно влияет на малые предприятия электронной коммерции, поскольку средние и крупные конкуренты часто могут предлагать товары по более низкой цене.
Например, такие гиганты, как Amazon и Walmart, обычно имеют услуги доставки, распределенные по всей стране. Их склады позволяют отправлять заказы с ближайшего предприятия. Таким образом, стоимость распространения снижается, а заказ доставляется очень быстро.
Решение: Это одна из проблем электронной коммерции, которая может создать или разрушить бизнес. Трудно добиться успеха на конкурентном рынке, но вы все равно можете найти способы распределения запасов по складам фулфилмента.Вы также можете стать чрезвычайно изобретательным грузоотправителем или найти уникальные продукты, которые потребители не смогут найти в другом месте.
9. Конкуренция с розничными торговцами и производителями
Многие интернет-магазины оптом закупают товары у производителей или дистрибьюторов, продавая их через Интернет. Это основная бизнес-модель электронной коммерции.
Но, отчасти из-за низкого барьера для входа в электронную коммерцию, производители продуктов и розничные торговцы также начали продавать напрямую потребителям.Компания, которая продает вашу продукцию, также может быть вашим конкурентом.
Например, ABC Garments продает товары на вашем онлайн-рынке и напрямую потребителям на своем веб-сайте. Даже некоторые производители создают дистрибьюторов, что ухудшает ситуацию.
Решение: Вы не можете запретить производителям продавать товары напрямую покупателям, но есть несколько тактик, которые можно попробовать:
- Отдавайте предпочтение производителям, которые с меньшей вероятностью будут продавать товары напрямую покупателям.
- Предложите товар по более низкой цене или с дополнительными преимуществами для увеличения продаж.
- Запретите производителю продавать продукт напрямую покупателям, указав это в контракте. Не для всех производителей это возможно, но таким образом можно работать с более мелкими.
10. Повышенный спрос на безопасность данных
Проблемы безопасности могут привести к кошмарным сценариям. Мошенники могут рассылать спам и заражать веб-сайты вирусами. Они потенциально могут получить доступ к конфиденциальным данным о телефонных номерах ваших клиентов, реквизитах карт и многом другом.
Распространенной проблемой электронной коммерции для интернет-магазинов являются проблемы с безопасностью, когда покупатели используют кредитные карты и добавляют личную информацию.Однако потребителей не волнует, что вы делаете, они ожидают, что вы их полностью защитите. Безопасность не следует рассматривать как часть проблем электронной коммерции — она должна быть просто необходимостью.
Решение: Вот несколько идей, чтобы убедиться, что ваш сайт безопасен:
- Управляйте своими собственными серверами.
- Не используйте общий FTP для передачи файлов
- Нанимайте службы кибербезопасности или инженеров
- Имейте эффективные процессы проверки (как мы упоминали в №1)
Кроме того, если какой-либо разработчик копирует файлы в открытую сеть Wi-Fi, пароли и другие конфиденциальные данные могут быть украдены.Постоянно обновляя корзину покупок, вы можете минимизировать риск кражи данных.
Большинство систем управления контентом хранят свои данные в базе данных. Разработчики должны регулярно делать резервные копии, извлекая данные в случае кражи.
WHITEPAPERПолное руководство по опыту работы с клиентами в электронной торговле
Проблемы электронной торговли могут быть возможностями
Чтобы выжить в жесткой конкуренции в электронной коммерции, необходимы выдающиеся стратегии. Будьте готовы решить все возможные проблемы электронной коммерции и сосредоточиться на формировании клиентоориентированной культуры.Таким образом, вы можете не только решить проблемы с обслуживанием клиентов, но и найти то, что движет вашими клиентами, и предложить им опыт покупок в Интернете, который они запомнят.
С какими проблемами электронной торговли сталкивается ваш бизнес? Какие решения вы пробовали? Оставить комментарий.
Николетта Бика
Старший специалист по контенту
Николетта — специалист по контенту в компании Acquire. Она писатель и редактор, страстно интересуется данными, технологиями, коммуникациями и путями взаимодействия с покупателем.
Глава 7 — Растворы — Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Резюме 7.11 Ссылки7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого.Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения.В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 Типы решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси, с другой стороны, неоднородны и имеют участки смеси, которые отличаются от других участков смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы будем обсуждать, происходит в жидких растворах, в которых вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 — это неполярные соединения , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 более высокая разница электроотрицательности полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Like Dissolves Like.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, показанное в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения упоминаются как электролиты . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси с помощью фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми, чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», — нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (водн.) → CO 2 2- (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котле.
Рисунок 7.5 Весы котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах с горячей водой могут значительно снизить пропускную способность труб. Эти отложения, называемые котловой накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В пункте тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни нужен растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать на поверхности более холодной, плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. Для этой популяции оптимальная температура воды составляет от 12,8 до 17,8 ° ° C (55-65 ° ° F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, которые затем уменьшили светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, который показывает влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация растворенных молекул газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ вступает в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (b) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — постоянная закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза более растворим, чем N 2 . Хотя силы лондонской дисперсии слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — концентрация и парциальное давление газа в исходном состоянии, соответственно, а C 2 и P 2 — концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. На этом этапе будет проще всего изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн.) И Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.При открытии бутылки давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой больше N 2 из воздуха растворяется во внутренних жидкостях дайвера. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Sesqui — 1½
- Di — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Hepta — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества считаются гигроскопичными и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, тогда как слишком мало приводит к разбавленному раствору, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химической записи квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Дважды проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Раствор:
(1) Измените приведенное выше уравнение, чтобы найти количество молей.
(2) Дважды проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или и в том, и в другом (т. Е. Масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 частей на миллион) и части на миллиард (10 9 ; частей на миллиард). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равно 1 экв. / Л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении, эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагировать или поставлять один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть математически выражено как:
где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в данном случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2- ионов.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквивалентов .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль Cr 2 O 7 2- анионов и 2 моль NH 4 + катионов. (Молекулы воды для ясности не показаны с молекулярной точки зрения.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1.43 M = 4,29 М. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 затем можно рассчитать, разделив 1,43 M на 4,29 M, получив 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Раствор:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 —, так что 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)7.10 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор — гомогенная смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества — это растворимых или нерастворимых , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся и несмешивающийся вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей.Утверждение « как растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество.Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества.Такими решениями являются насыщенных . Растворы, у которых количество меньше максимального, — это ненасыщенных . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объемный / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего похоже на химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали основной раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием основного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1.08 M, h4PO4 = 0.816 M, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
Список литературы
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д. У., Хилл, Дж. У.и Скотт Р.Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Нижний, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
Калькулятор квадратичных формул
Использование калькулятора
Этот онлайн-калькулятор представляет собой решатель квадратного уравнения , который решит полиномиальное уравнение второго порядка, такое как ax 2 + bx + c = 0 для x, где a 0, используя квадратная формула .2 — 4ac> 0 \) Итак, есть два действительных корня.
Упростите радикал:
\ (x = \ dfrac {8 \ pm 2 \ sqrt {11} \,} {2} \)
\ (x = \ dfrac {8} {2} \ pm \ dfrac {2 \ sqrt {11} \,} {2} \)
Упростить дроби и / или знаки:
\ (x = 4 \ pm \ sqrt {11} \, \)
, что становится
\ (х = 7.2 — 4ac <0 \), значит, есть два комплексных корня.
Упростите радикал:
\ (x = \ dfrac {-20 \ pm 4 \ sqrt {15} \, i} {10} \)
\ (x = \ dfrac {-20} {10} \ pm \ dfrac {4 \ sqrt {15} \, i} {10} \)
Упростить дроби и / или знаки:
\ (x = -2 \ pm \ dfrac {2 \ sqrt {15} \, i} {5} \)
, что становится
\ (х = -2 + 1.54919 \, и \)
\ (х = -2 — 1,54919 \, я \)
Калькуляторобновлен и включает полное решение для действительных и комплексных корней
7 лучших примеров ценностных предложений, которые мы когда-либо видели
Ценностное предложение вашего бизнеса, возможно, является наиболее важным элементом вашего общего маркетингового сообщения. Ценностное предложение говорит потенциальным клиентам, почему им следует вести дела с вами, а не с вашими конкурентами, и с самого начала делает очевидными преимущества ваших продуктов или услуг.
К сожалению, многие компании либо хоронят свое ценностное предложение в модных словах или банальных, бессмысленных лозунгах, либо не выделяют его на своем сайте и в своих маркетинговых кампаниях — либо они вообще не понимают, что это такое!
Сегодня мы рассмотрим семи лучших примеров уникальных ценностных предложений, с которыми мы столкнулись. Мы обсудим, что делает их такими привлекательными, некоторые идеи по развитию или уточнению вашего собственного ценностного предложения, а также вещи, которые следует учитывать при включении вашего ценностного предложения в свой веб-сайт и маркетинговые материалы.Есть еще кое-что, что нужно покрыть, так что давайте прямо сейчас.
1. Uber — самый разумный способ добраться до
Немногие технологические компании вызывают такую поляризацию или критику, как Uber. Как один из самых ярых сторонников расширения прав и возможностей, предлагаемых так называемой «гиг-экономикой», Uber заслуженно подвергся резкой критике за то, что отказал своим водителям в базовой защите, предоставляемой легальным сотрудникам, и подвергся проверке со стороны государства и даже правительства. его решение инкорпорироваться на Бермудских островах, чтобы избежать корпоративных налоговых обязательств, и, как правило, является примером того, почему все ненавидят уникальный бренд Кремниевой долины — «разрушение».”
Одна вещь, которую Uber определенно делает правильно, — это его уникальное ценностное предложение.
Ценностное предложение Uber, предлагающее Uber удобство
Не говоря об этом прямо, Uber умело выделяет все, что отстой в использовании традиционного такси, и указывает на то, что его услуги лучше. Простая (но очень эффективная) копия выше, взятая с домашней страницы Uber, превосходно передает простоту и легкость, лежащие в основе того, что делает эту услугу такой заманчивой:
- Одно нажатие — и машина прямо к вам
- Ваш водитель точно знает, куда идти
- Оплата полностью безналичная
Все в этом прямо противоположно типичному опыту получения такси — никаких телефонных звонков незаинтересованным диспетчерам, никаких болезненных разговоров, пытающихся объяснить измученному таксисту, где вам нужно быть, и никакой возни с мелочами или беспокойства о вас » У тебя в кошельке достаточно купюр.Просто быстрый и эффективный способ добраться туда, куда вы собираетесь. Это подкрепляется вдохновляющими сообщениями в верхней части главной страницы Uber, в которых говорится: «Ваш день принадлежит вам».
На этом этапе стоит сравнить ценностное предложение Uber с конкурирующей компанией Lyft. Предложения двух компаний практически идентичны, что делает их прямое сравнение таким интересным. Взгляните на эту информацию на домашней странице Lyft:
Пошаговое ценностное предложение Lyft
По структуре и тематике главная страница Lyft очень похожа на страницу Uber.Однако здесь есть некоторые ключевые отличия, которые подчеркивают, как ценностное предложение Uber позиционируется более четко.
Во-первых, Lyft получает несколько баллов за включение нескольких пошаговых изображений опыта Lyft, помогающих посетителям визуализировать, что такое поездка с Lyft. Однако посмотрите на копию для первого шага процесса. В нем перечислены три уровня обслуживания Lyft — Lyft, Lyft Line и Lyft Plus, но не объясняется разница между этими уровнями обслуживания и не объясняется, почему потенциальному клиенту следует выбирать между ними.
Кроме того, четко объясняя заключительный этап процесса — оплату и оценку водителю — эта информация подразумевает, что от пользователя требуется окончательное определенное действие, чего Uber не выполняет. Лично я почти всегда пытаюсь оценить своих водителей Uber (имея в виду часто предполагаемый «секретный» рейтинг около 4,6 из 5, который, по мнению многих, служит эталоном производительности для водителей Uber), но у меня нет к. Иногда я забываю об этом и просто продолжаю свой день — это, конечно, не требуется, и при этом я не оплачиваю моего водителя вручную.Для службы, построенной на принципах эффективности и удобства, это очень важно.
Теперь можно утверждать, что Lyft лучше справляется с задачей прозрачности в отношении того, чего могут ожидать пользователи, — аргумент, который определенно заслуживает внимания, особенно если вы когда-либо были уязвлены неожиданным «скачком» цен Uber. Тем не менее, в отношении двух таких похожих сервисов я бы сказал, что ценностное предложение Uber позиционируется более четко и, безусловно, более убедительно, чем у Lyft — важное отличие, если вы работаете на переполненном рынке с несколькими похожими конкурентами.
>> Улучшите свою игру с помощью нашей БЕСПЛАТНОЙ книги всех звезд по онлайн-рекламе. Получите здесь бесплатно
<<2. Apple iPhone — опыт — это продукт
Даже на сегодняшнем перенасыщенном рынке бытовой электроники трудно представить более культовый продукт, чем Apple iPhone. Также сложно представить продукт с такой большой конкуренцией, как флагманское мобильное устройство Apple, так что же отличает iPhone от (буквально) сотен конкурирующих устройств на рынке?
Ценностное предложение Apple для iPhone, предлагающее уникальный опыт
Как и следовало ожидать от Apple, фирмы, известной своим стремлением к гладкому и элегантному дизайну продуктов, Apple твердо повторяет свое ценностное предложение в тексте о своем ассортименте продуктов для iPhone — в частности, о дизайне само устройство, простота использования, которая была краеугольным камнем эстетики дизайна Apple с момента запуска OS X, и желаемые качества, которые iPhone якобы предлагает пользователю.
Это вдохновляющее сообщение — это ценностное предложение Apple.
Посмотрите на копию. Apple заявляет, что считает, что телефон «должен быть больше, чем набор функций», но это именно то, чем является смартфон. Мы могли бы сидеть здесь и подшучивать над возвышенной эстетикой дизайна Apple в течение нескольких дней (яркий пример — хэштег #freejonyive в Твиттере, который шутит, что ведущий дизайнер Apple находится в ловушке в белой комнате в течение нескольких лет), но это замечательно эффективно. подход, который помог Apple оставаться в авангарде жестоко конкурентного рынка в течение почти десятилетия.
Джони Айв (#freejonyive)
Apple знает, насколько переполнен и конкурентоспособен рынок интеллектуальных устройств, поэтому вместо того, чтобы сосредоточиться на конкретной функции — практически ни одна из которых не является уникальной для iPhone или iOS, — компания вместо этого предпочитает сосредоточиться на опыте использования iPhone. Большинство компаний не могут использовать такие слова, как «волшебный», чтобы описать использование смартфона, но Apple может.
Конечно, Apple не просто почивает на лаврах и полагается на вдохновляющие сообщения, чтобы продать вам свое ценностное предложение.Официальный сайт iPhone также затрагивает несколько действительно уникальных функций iPhone и iOS, в том числе безопасность:
Стоимость Apple Iphone предложение, ориентированное на безопасность
Мало того, что это очень умный ход со стороны Apple (особенно после катастрофического иска ФБР о разблокировке iPhone в Сан-Бернардино), но и копия полностью соответствует остальным сообщениям Apple и позволяет упростить невероятно сложную тему — шифрование — до легко понятный язык, который понятен большинству пользователей и который нравится большинству пользователей.
Apple понимает, что даже сосредоточения внимания на уникальных функциях iPhone недостаточно, чтобы выделить устройство на таком переполненном рынке. Однако, подчеркивая общий опыт использования устройства , ценностное предложение Apple столь же уникально, как и ее подход к дизайну и эстетике продукта.
3. Unbounce — A / B-тестирование без технических проблем
Отойдя от мира потребительской электроники и приложений и перейдя на территорию B2B, наш пятый пример ценностного предложения исходит от наших друзей из платформы оптимизации целевой страницы Unbounce.
Ценностное предложение Unbounce, обеспечивающее простоту использования
Как и следовало ожидать от компании, специализирующейся на оптимизации коэффициента конверсии, ценностное предложение Unbounce совершенно очевидно с того момента, как вы попадаете на главную страницу, а именно возможность создавать, публиковать и тестировать целевые страницы без каких-либо информационных технологий. служба поддержки. Для многих малых предприятий (и даже более крупных компаний) предполагаемые технические накладные расходы на A / B-тестирование являются серьезным препятствием для входа, что делает ценностное предложение Unbounce особенно привлекательным.
Эта домашняя страница также может похвастаться рядом других функций, которые делают общее впечатление очень привлекательным, такими как сильный, неотвратимый призыв к действию и простое трехэтапное визуальное представление того, как работает решение Unbounce. В тексте также четко указано, что Unbounce в первую очередь нацелен на маркетологов (четкое указание на понимание и обращение к очень конкретной целевой аудитории), а также на тот факт, что пользователи могут создавать мобильные целевые страницы, которые сами по себе удовлетворяют очень специфические потребности. или беспокойство для некоторых маркетологов.Вокруг отличный материал.
4. Расслабление — будьте более продуктивными в работе с меньшими усилиями
Кажется, что мир делится на два типа людей; тем, кто любит Slack, и тем, кто еще не пробовал. Для непосвященных Slack — это приложение для повышения производительности на рабочем месте и обмена сообщениями. Он обманчиво прост в использовании, но достаточно надежен для больших команд, работающих над сложными проектами (о чем свидетельствует очень умное включение в Slack примера NASA Jet Propulsion Lab на домашней странице), что отличает Slack от тысяч других приложений для обмена сообщениями и повышения производительности. ?
Ценностное предложение Slack с упором на надежность и производительность
По сути, Slack воплощает свое ценностное предложение в приведенном выше примере — он делает «рабочую жизнь пользователей проще, приятнее и продуктивнее».Пример NASA JPL также очень умен в том, что он тонко подразумевает, что если он достаточно хорош для больших групп ученых в НАСА — типа людей, которые размещают роботов на других планетах, — то он достаточно хорош для всех.
Однако, хотя это может показаться преимуществом практически каждого приложения для повышения производительности на рынке, Slack имеет несколько преимуществ, которые поддерживают его основную ценность — упрощение совместной работы.
С одной стороны, немногие (если вообще есть) другие приложения для повышения производительности могут похвастаться таким количеством интеграций, как Slack.Это означает, что он почти гарантированно впишется практически в существующий коммуникационный рабочий процесс любой компании. Именно это разнообразие поддерживаемых приложений помогло Slack практически единолично доминировать на рабочем месте.
«Slack: все инструменты в одном месте».
Простота также является ключевой темой ценностного предложения Slack. В конце концов, трудно сделать больше, если приложение, которое обещает помочь вам в этом, является головной болью в использовании.Предпосылка «найти что угодно, где угодно, когда угодно, с любого устройства» — это еще один аргумент, о котором пользователи Slack регулярно проповедуют, и на то есть веские причины.
«Slack: поиск по всему архиву».
Я не буду анализировать каждый аспект Slack, но достаточно сказать, что обмен сообщениями и позиционирование Slack по сути решает все распространенные проблемы, которые вы можете придумать при сотрудничестве с другими на работе, а затем упрощает его почти непреодолимым образом.Новичкам это может показаться слишком хорошим, чтобы быть правдой, и, возможно, именно поэтому Slack стал настолько безумно популярным (и помог компании достичь головокружительной оценки в 3,8 миллиарда долларов). Перечитывая веб-сайт Slack, вы можете почти почувствовать вздоха облегчения, которые обещает Slack.
МантраSlack «Будь менее занятым» — это не просто запоминающийся слоган — это ценностное предложение компании, аккуратно сформулированное в трех красивых простых словах.
5. Digit — экономьте деньги, не задумываясь об этом
Мир личных финансов — это еще одно пространство безжалостной конкуренции, и существуют десятки тысяч приложений, призванных помочь людям более эффективно управлять своими деньгами.Однако у немногих есть такое выгодное предложение, как Digit, относительно новая услуга, которая помогает пользователям «экономить деньги, не задумываясь об этом».
Ценностное предложение Digit, обеспечивающее автоматическую экономию
Digit позволяет пользователям безопасно подключать свои банковские счета к сервису Digit, который затем алгоритмически проверяет привычки и регулярные расходы пользователей. Затем он начинает «оптимизировать» учетные записи пользователей, чтобы перебрасывать немного денег здесь и там на сберегательный счет, гарантированный FDIC, с которого пользователи могут снимать свои сбережения в любое время.
Ключевым отличием Digit от других сберегательных приложений является то, что процесс полностью автоматизирован. Пользователям буквально не нужно ничего делать, чтобы Digit начал вкладывать деньги на сберегательный счет; несколько баксов здесь, несколько баксов там, и, прежде чем вы это узнаете, у вас есть приличная сумма, отложенная на черный день, при этом у вас остается достаточно средств для покрытия регулярных исходящих расходов. Это действительно потрясающе.
Сбережения могут стать серьезным финансовым препятствием для многих людей, особенно людей с ограниченными или ограниченными доходами.Автоматизируя весь процесс, Digit предлагает пользователям полностью автоматизированное решение для экономии. Он не для всех — но опять же, ни один продукт, услуга или приложение — но он уникален, и его ценностное предложение ясно показывает это.
6. LessAccounting — Бухгалтерия без хлопот
Для большинства людей (читай: людей, не являющихся специалистами по бухгалтерскому учету и бухгалтерскому учету) бухгалтерский учет — это головная боль. Это сбивает с толку, требует много времени и, как правило, крайне неприятно, даже если бухгалтерские книги вашего бизнеса относительно просты.Вот что делает ценностное предложение LessAccounting таким привлекательным.
Ценностное предложение LessAccounting, повышающее качество жизни
Вся предпосылкаLessAccounting основана на упрощении бухгалтерского учета и бухгалтерского учета, и его ценностное предложение усиливается по всему сайту. Слоган домашней страницы — «Сделайте свою жизнь проще с нашим бухгалтерским программным обеспечением» — делает это сразу очевидным, и, когда вы перемещаетесь по сайту, вам постоянно напоминают о ценностном предложении продукта, а именно о том, что никакое другое бухгалтерское программное обеспечение не делает бухгалтерский учет таким простым и безболезненно, как LessAccounting.
Хотя LessAccounting доступен для крупных предприятий, он в первую очередь нацелен на небольшие предприятия, такие как фрилансеры и владельцы малого бизнеса, и его сообщения отражают это на каждом этапе воронки. От сообщений в блогах, которые отвечают на вопросы, которые, вероятно, возникнут у новичков в бухгалтерском учете, до тематических исследований, в которых владельцы малого бизнеса хвалят простоту и удобство использования продукта, каждый аспект обмена сообщениями LessAccounting фокусируется на том, насколько проще и проще станет ваша жизнь, если использовать Меньше бухгалтерского учета.
7. CrazyEgg — Отслеживание поведения на веб-сайте по непревзойденной цене
Точное определение того, как люди используют ваш веб-сайт, является серьезной проблемой для многих предприятий. Вы могли думать, что имеете хорошее представление о поведении ваших пользователей, но без точных, действенных данных вы не можете знать наверняка. Вот где на помощь приходит CrazyEgg.
«CrazyEgg: Хотите улучшить свой сайт?»
CrazyEgg — это аналитический инструмент, который позволяет пользователям просматривать тепловые карты того, как люди на самом деле взаимодействуют с веб-сайтом.Пользователи могут видеть движения курсора, глубину прокрутки и множество других интересных функций отслеживания поведения, которые позволяют им действительно понять, как люди взаимодействуют с их веб-сайтом.
Однако CrazyEgg — далеко не единственный игрок в области отслеживания поведения — так в чем же ценность предложения? То, что ни один другой сервис не предоставляет больше функциональности и понимания по лучшей цене, с такими же небольшими хлопотами, как CrazyEgg.
«CrazyEgg: как пара рентгеновских очков»
Умные люди в CrazyEgg понимают, что не каждый, кто посещает их сайт, знаком с концепцией тепловых карт или поведенческого отслеживания, поэтому они предоставляют посетителям удобный и доступный обзор функций CrazyEgg, чтобы упростить то, что делает продукт.Если вы прокрутите этот обзор, вы попадете в самую суть ценностного предложения CrazyEgg:
Ценностное предложение CrazyEgg, ответы на интуитивно понятные часто задаваемые вопросы с активной дикцией
На сайте перечислено все, что пользователи могут делать с CrazyEgg, с умным использованием активных глаголов, чтобы показать посетителям, насколько лучше их жизнь станет с его помощью. Этот список соблазняет потенциальных пользователей расширять свои бюджеты, выступая за изменения сайта с использованием действенных данных, делая тестирование и аналитику проще и эффективнее, а также обещая больше конверсий и повышенное участие.
Затем он подчеркивает простоту использования, с которой может быть реализован CrazyEgg, подчеркивая тот факт, что использование продукта практически не требует технических накладных расходов, прежде чем констатировать еще один ключевой аспект его ценностного предложения, а именно то, что он является наиболее полнофункциональным. продукт своего типа в своем ценовом диапазоне.
Если учесть общий поток на этой странице, он действительно очень умный. Он использует простой, доступный язык и задает вопрос, призванный заинтересовать пользователей, прежде чем дать четкое представление о том, что вы можете с ним сделать, а затем закрепляет сделку, выделяя центральные элементы ценностного предложения.
Придание собственной ценности
Надеюсь, эти примеры ценностных предложений дали вам некоторые идеи о том, как вы можете улучшить или прояснить ценностные предложения своего бизнеса. Вам не нужен громадный бюджет на маркетинг или дизайн, чтобы сделать то, что делает ваш бизнес лучшим, в центре вашего обмена сообщениями — достаточно немного сосредоточиться и пара минут, чтобы рассмотреть свой сайт с точки зрения пользователей.
Киберпонедельник — скидка 70%. Конец 29.11.
Elite
Расчет заработной платы, интегрированное отслеживание рабочего времени и другие инструменты для команд с более сложными потребностями.
- Заработная плата с полным обслуживанием
- Автоматическая начисление заработной платы
- Медицинские пособия для вашей команды, предоставляемые SimplyInsured **
- Экспертная поддержка продуктов
- Прямой депозит в тот же день
- Центр поддержки HR, предоставленный Mineral **
- Индивидуальная настройка белых перчаток
- Круглосуточная экспертная поддержка продуктов
- Отслеживание времени и проектов на ходу
- Защита от налоговых штрафов
- Персональный консультант по персоналу
- Управление заработной платы
Включенные функции:

 Можно настроить диапазон числел и ответов: до 10, до 20, до 100, примеры с трёхзначными, четёрыхзначными и пятизначными сичлами. Настраивается сложность примеров: с переходом через десяток или без перехода, сложение или вычитание, действия с «удобными» числами или примеры повышенной сложности…
Можно настроить диапазон числел и ответов: до 10, до 20, до 100, примеры с трёхзначными, четёрыхзначными и пятизначными сичлами. Настраивается сложность примеров: с переходом через десяток или без перехода, сложение или вычитание, действия с «удобными» числами или примеры повышенной сложности…
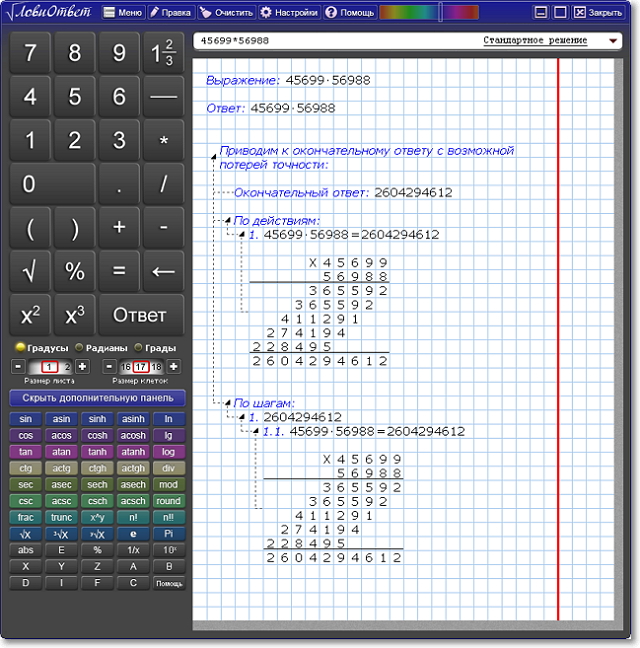




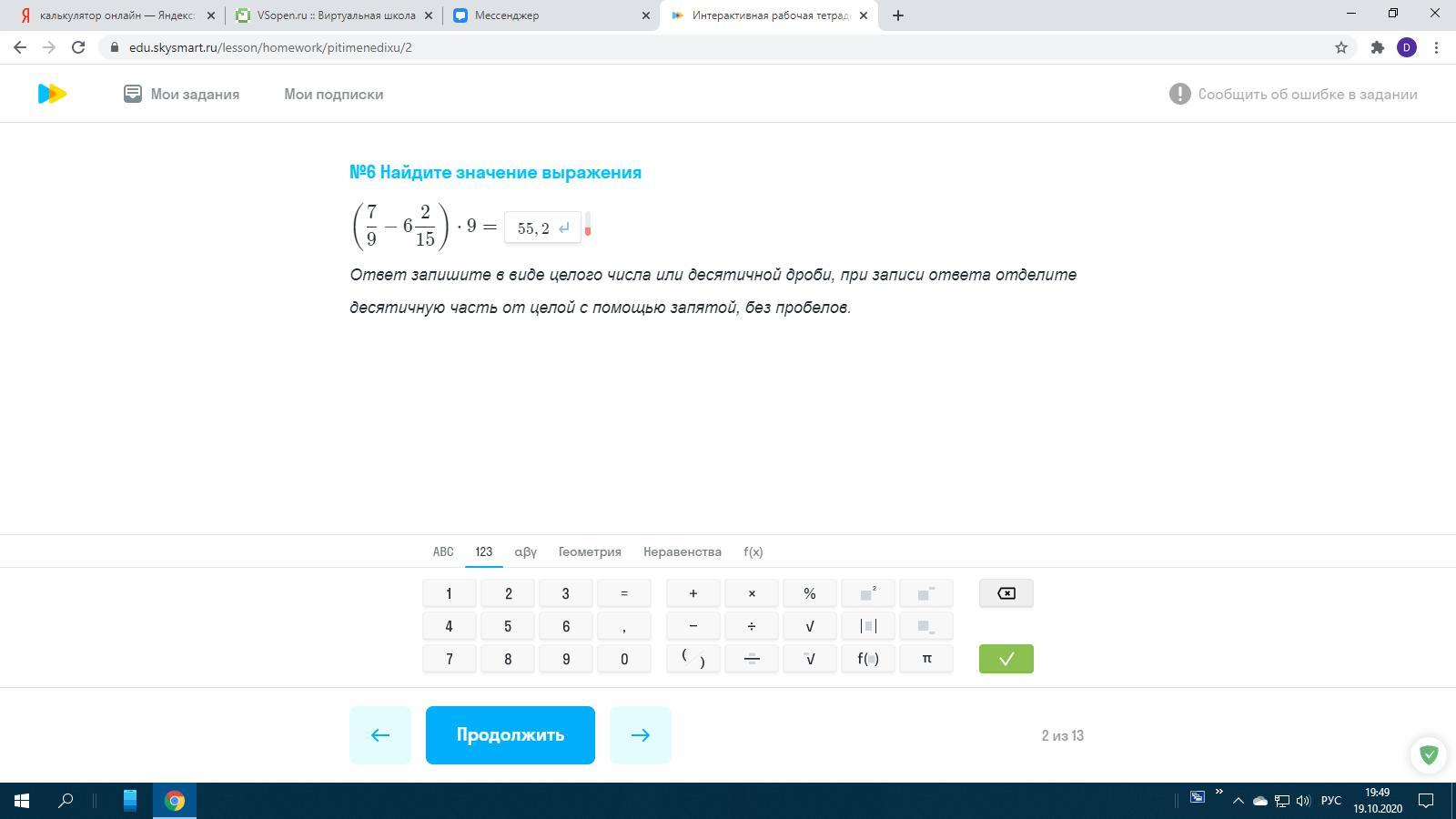
 Программа отлично пригодится для подготовки к предстоящим экзаменам по математике, она бесплатна и способна эффективно работать без Интернета. Просто запустите приложение, отсканируйте с помощью камеры телефона текст задачи, и вы получите необходимый ответ. Предоставляемое решение программа разбивает на простые шаги для лучшего понимания алгоритма ответа;
Программа отлично пригодится для подготовки к предстоящим экзаменам по математике, она бесплатна и способна эффективно работать без Интернета. Просто запустите приложение, отсканируйте с помощью камеры телефона текст задачи, и вы получите необходимый ответ. Предоставляемое решение программа разбивает на простые шаги для лучшего понимания алгоритма ответа; Хорошо понимает различные типы математических задач, справляется с полиноминальными уравнениями различных степеней, решает тригонометрические уравнения, системы уравнений и другое.
Хорошо понимает различные типы математических задач, справляется с полиноминальными уравнениями различных степеней, решает тригонометрические уравнения, системы уравнений и другое.